
2017年3月
在遠古時期的人類,從居住的環境、氣候變遷,如炎熱的陽光、冰冷的河水、清涼的樹林、炙熱的沙漠、酷冷的風雪、燒燙的油脂等,對冷熱已有初步的接觸和體驗;直到懂得使用火來烹煮食物或驅逐猛獸之後,對冷熱及其應用有了更進一步的認識。然而到了17世紀,由於溫度計的發明,科學家們得以利用溫度計對冷熱加以量化,才開啟了熱學的研究。
至今,溫度仍是生活中最常遇到的物理量;當身體不舒服時,會想量一下體溫;早上出門前聽一下氣象預報來決定服裝的穿著;為了節能減碳,政府常鼓勵民眾冷氣設定在28 ℃,熱水器及飲水器也都有溫度調整裝置。雖然溫度和我們那麼接近,但是卻難以捉摸。有聽過「房間比以前明亮了十倍」或「這條魚只有那條魚一半重」,卻未曾聽過「牛乳的溫度已降一半了」。我們都知道一公斤蘋果加上一公斤蘋果為兩公斤蘋果,連續走兩次一公里的路即走了兩公里,十秒鐘加上十秒鐘等於二十秒鐘,但將50 ℃的水倒入另一杯50 ℃的水中,卻不是變成100 ℃的水。
熱量與溫度
清晨赤腳到戶外走動,會覺得石板地較草坪冷,因為從腳底流到石板地的熱量比流到草坪裡的多一些,這種感覺會讓人以為石板地的溫度比草坪的溫度低一些。不過,到了下午三點,踩在陽光曬過的石板地,卻覺得比草坪地要熱得多,難道那時候石板地的溫度高過了草坪嗎?「熱量」和「溫度」這兩個物理觀念極易混淆不清,十八世紀中葉以前,多數人認為溫度高低即代表物體含熱量的多少,物體溫度愈高,含熱量即愈多。當時大家都知道兩個溫度不同的物體相接觸時,熱量會由高溫的物體流向低溫的物體,直到兩物體達到相同的冷熱程度,即兩物體最後的溫度會相等,此即為一種熱平衡現象。
荷蘭醫生及植物學家布爾哈夫(Herman Boerhaave)認為熱像一種會流動的物質,稱之為熱質;吸收或釋放熱質的多寡稱為熱量。他從實驗中證明釋放的熱量等於吸收的熱量,並提出溫度代表含熱多寡的概念,但是對於不同質量或不同材質混合的溫度變化,就無法解釋。後來蘇格蘭的化學家布萊克(Joseph Black) 成功地釐清熱量與溫度的概念:溫度不能代表含熱的多寡,兩物體到達熱平衡的過程中,溫度高的物體所釋放的熱量等於溫度低的物體所吸收的熱量。
十八世紀的科學家認為熱是一種無色、無味且沒有質量的流質之熱質說,到了該世紀末受到了摩擦生熱之運動(熱能)說的嚴重挑戰,到了十九世紀中葉,英國物理學家焦耳(James Prescott Joule) 及德國科學家梅耶(Julius Robert von Mayer) 均提出熱為能量形式的一種,焦耳並進行了熱功當量的重錘實驗(如圖一),計算出熱量和功之間的轉換比值,確認熱是能量的另一種形式,並對熱定義為:物體間因溫度差、或相變(phase transition)而產生的能量轉移,稱之為熱。而後推論出因物質內部發生的原子運動,這些肉眼看不見的運動無時無刻都存在,物體的溫度則與原子在物體內的運動有關,當我們覺得某物體比較熱時,即表示它的原子動能大。從此熱質說才被放棄,而熱量與溫度的關係也逐漸明朗化。

圖一 量測熱功當量的裝置
溫度量測
由於感官的限制,人們不可能在極熱或極冷的環境下進行分辨冷熱的工作,又因人對於物體或天候環境冷熱的感覺,其實都是個人主觀的感受和意見,不但不精確而且因人而異。如在日常生活中,常會聽到類似以下形容冷熱的對話;甲說:「最近天氣好冷。」乙卻說:「還好吧!涼涼的好舒服啊!」此外,在溫泉澡堂裡,也會聽到有人說:「這水好燙啊!」另有人卻說:「不會啊!我覺得剛好。」因此在科學的觀點上,人類的感覺不客觀,不足以擔任溫度感知與量測的重任。
另一方面,溫度係表示物質內部所持有之熱能的量,雖然在絕對零度(0 K)時,原子和分子的振動被假設為定全停止的狀態,但人卻無法感受到此一絕對零度。人對於冷熱的感覺,可能用相對性的比較方式去體驗熱或冷,如母親用手或額頭觸摸孩子的額頭有沒有比較熱的感覺(或說比自己體溫熱)來判斷是否有發燒現象。此一方法並不是量測溫度,而是感測熱的流動而已。由於人的體溫比較穩定,而且手也有冷熱的感知功能,可以說是一種簡易的溫度感知器,不過卻無法量化量測的結果。
由此可知,若要正確量測物體的溫度,首先必需採用一種其物理特性會隨溫度的改變而有明顯且穩定的變化。譬如:金屬材料的電阻會隨溫度的升降而變化,如以熱敏電阻為感測器的電子體溫計;空氣、水銀、酒精或金屬的體積會隨溫度的升降而膨脹或收縮,如利用酒精的熱膨脹特性的玻璃溫度計;物體發熱會因溫度的變化而有不同的輻射波長,如應用紅外線感測器量測耳膜的熱輻射之耳式體溫計。
其次,需要一個溫度的基準(溫度參考點) 。一般來說,拿某物跟一個固定標準比較,以決定此物是熱或冷,而此物跟該標準在冷熱程度上的差距,即所謂的「溫度」。因此,利用某種特有的物理現象發生時之溫度為基準,例如將碎冰塊浸入水中來實現水的凝固點,又可將水加熱煮沸實現沸點;當然這些溫度參考點係隨壓力而改變,不過如在日常生活中所要求的準確度範圍內,這是可用且能輕易實現的。而後科學家們即利用如同「凝固點」和「沸點」等物質相變(Phase transition)時之溫度的再現性作為溫度參考點,並稱之為溫度定點。再利用兩個溫度定點作為溫度計的上標參考點和下標參考點,並將中間範圍平均分成若干單位,即可用來量測溫度;此溫度參考點即為「溫標」。
溫度計與溫標的演進
與其說溫度計是由誰發明的,倒不如說是經由發展改進出來的,最早有關溫度計的裝置可追溯至公元前一世紀左右,大約在西元前240年,拜占庭的菲洛(Philo of Byzantium)製造第一個類似溫度計的設備(如圖二)。依據亞歷山卓的希羅(Hero of Alexandria)的著作所記載,它是一支細管子從一個密閉的空鉛球引出,此細管子的前端置入開放式水罐中。當鉛球被太陽照射加熱時,球內的空氣體積會膨脹,使水中產生氣泡。反之,將鉛球放入蔭涼處時,則球內的空氣體積收縮,使水上升入細管中,藉由細管子吸入水或排出水的現象來得知溫度的變化。
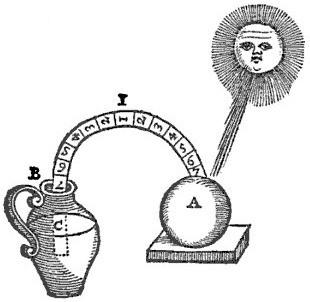
圖二 菲洛測溫裝置,圖片來源網址
1592年,義大利科學家伽利略(Galileo Galilei)製作一支和菲洛測溫裝置相同原理的測溫器(thermoscope)。它是一支如吸管的玻璃管,連接在一只中空的玻璃球上,而此玻璃管的前端插入水罐中。當玻璃球式加熱或冷卻時,管中的水即會隨之有上升或下降的變化,並在管子前後端作兩個記號為量程(span)標誌。據說他的醫生朋友山多里歐(Sanctorius Sanctorius)將此裝置加以改良,用來量測病患的體溫,有可能是史上最早的體溫計。
伽利略的測溫器因為會受到大氣壓力的影響,不能稱為真正的溫度計。十七世紀中葉,義大利科學家塔斯卡尼(Tuscany)大公斐迪南二世(Ferdinando II de' Medici)將玻璃球和玻璃管抽真空並注入液體(有色酒精)後封閉,這溫度計的原理和現代溫度計非常相似,它利用玻璃內的液體體積會隨溫度而變化,且不受大氣壓力的影響而作成的。因為塔斯卡尼的首府為佛羅倫斯(Florence),故此溫度計被人稱為佛羅倫斯溫度計(Florentine thermometers)。不過,當時這種溫度計的標度係以當地的最高氣溫和最低氣溫為準,又因歐洲就有許多科學家陸續定了各式溫標,如海更斯(Christiaan Huygens) 在1665年建議採用水的凝固點和沸點為溫標,義大利計量學家雷納爾迪尼(Carlo Rinaldini)也提出並將此兩定點作為溫度計的溫標。1701年牛頓(Isaac Newton) 提出在水的凝固點和人的體溫之間分十二等分以度量溫度。
1709年,著名的德國物理學家華倫海特(Daniel Gabriel Fahrenheit)發明了第一支實用酒精溫度計,1714年又改用水銀作測溫物質製成水銀溫度計。他在1724年一篇期刊上發表所使用之三個參考溫度來標示溫度計的刻度,定出了歷史上第一個經驗溫標–華氏溫標,使溫度測量第一次有了統一的標準。最初華倫海特選用之第一個溫標係由冰、水以及氯化銨所混合之溶液的溫度,並定溫度計所量得的刻度為0 ℉(約-17.8 ℃),這是當時能製造出的最低溫度;其次把健康人的體溫作為第二個溫標,定為96 ℉(約35.6 ℃)。而後又把剛好有冰形成於水之表面的混合物溫度作為第三個溫標,定為32 ℉(0 ℃)。後來華倫海特又擴展了他的溫標,把水在標準大氣壓下的沸點作為一個溫標,定為212 ℉(約100 ℃)。1724年正式確立了以他的名字命名此一溫標為「華氏溫標」。華氏溫標規定水的凝固點(標準大氣壓下冰與被空氣飽和的水之間的平衡溫度)為32度,水的沸點(標準大氣壓下水和水蒸氣之間的平衡溫度)為212度。隨著科學技術的進步,人們早就不再用華氏溫標,至今仍有一些國家(美國和加拿大等)在許多情況下繼續使用華氏溫度,但這已不是原來的華氏溫標所定義的溫度。
1742年,瑞典天文學家攝爾修斯(Anders Celsius, 1701-1744)將一大氣壓下的水的沸點規定為0 ℃,凝固點定為100 ℃,兩者間均分成100個刻度,和現行的攝氏溫標剛好相反。1744年,瑞典生物學家林奈(Carl Linnaeus) 將之修成現行的攝氏溫標:水的凝固點定為0 ℃(273.15 K),水的沸點定為100 ℃(373.15 K)用於溫室實驗。1954年的第十屆國際度量衡大會特別將此溫標命名為「攝氏溫標」,以表彰攝爾修斯的貢獻。
在十八世紀,當時對於熱狀態沒有足夠研究的情況下,認為物體屬性在所觀察的溫度間隔內都是均勻變化,於是將兩個定點溫標的間隔採平均分成小刻度。然而經過後來實驗證明,封入溫度計的液體其熱膨脹係數並非恆定,概依溫度的變化和物質不同而有所差異,將0 ℃ 到100 ℃之間以100等分分割,到底是基於什麼基準?對於這個問題,若採用英國科學家克耳文男爵(William Thomson, 1st Baron Kelvin)在1848年所提的熱力學溫標就得以解決。
被尊稱為熱力學之父的克耳文利用熱力學第二定律的推論-卡諾循環定理,推薦一個與測溫物質的屬性無關的熱力學溫標(又稱為克氏溫標)。此溫標以物質中不能再抽取任何內能時的溫度為零度,亦稱為絕對零度(absolute zero) 即任何物質中每一粒子皆無動能可傳遞時的溫度。絕對零度是僅存於理論的下限值,依理想氣體理論推導等於攝氏溫標零下273.15度(−273.15 ℃)。克氏溫標本身並沒有負值的溫度,是一個不能實現的純理論溫標,因為可逆的卡諾循環在自然界並不存在,且絕對零度在現實上亦達不到。因此,需以其他定值的溫度點重現國際溫標,以適應溫度量測的發展。
國際單位制的溫度單位
1954年第10屆國際度量衡大會(General Conference on Weights and Measures;CGPM) 決定以水的三相點為基本定點熱力學溫標,並指定它的溫度為273.16克氏度(°K)。三相點是指密閉系統中,ㄧ種物質的三相(氣相、液相、固相)同時存在,可互相達到平衡的唯一溫度及壓力(圖三)。舉例來說,水的三相點在0.01 ℃及611.73 Pa;汞的三相點是 −38.8344 °C及0.2 MPa。水有一個特別的相圖,當水、冰和水蒸汽三相可以共存於一個穩定的平衡,壓力和溫度任意小的變化,都會改變其狀態。因此,水的三相點可用來作為制定熱力學溫標的標準,也可作為校正溫度計的標準。
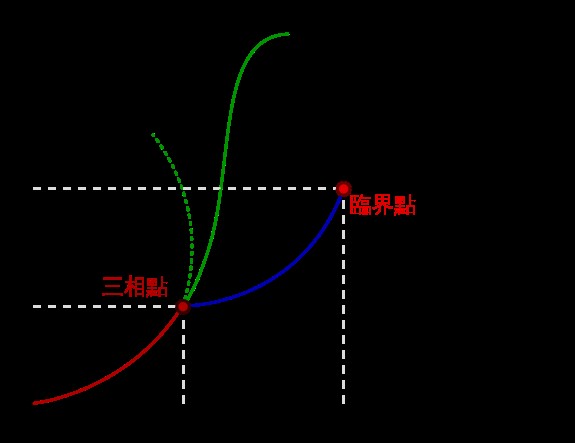
圖三 相圖中的三相點, 圖片來源網址
對於溫度的量測,單單溫標的選擇還不夠。為能根據溫標進行數值計算,宜選擇適當的量測單位。而後科學界為使熱力學溫標與攝氏溫度之間保留一定的關聯,將水的凝固點與沸點之間隔,仍採用相等分之100 度;即熱力學溫標的每一刻度大小與攝氏一度相同,當時仍稱為「克耳文度」,以 “ °K ”表示。1967年第13屆國際度量衡大會認為熱力學溫度的單位和溫度間隔的單位宜採用相同名稱和符號,決議廢除「克耳文度」的名稱及符號“ °K ” ,而改為「克耳文 (kelvin)」,符號為 “ K ” 。同時也決議熱力學溫度單位的定義為:熱力學溫度單位克耳文等於水在三相點之熱力學溫度的273.16分之1。由於水的三相點在攝氏溫標上為0.01 ℃,所以0 ℃等於273.15 K;而熱力學溫標的零點,即絕對零度,記為0 K。
國際溫標的演進
早期溫標中的溫度定點原僅隨意的選定,而後知道水的凝固點與沸點會隨著水的成分、壓力等因素而改變。因此,若要進行更精準的溫度量測,必需有比凝固點與沸點更佳的一些定點,並在各溫度定點之間確立精準的內插方法。依據這些需求所建立的溫標,經國際上科學界所共同認定,即為國際溫標(International Temperature Scale)。
另一種最接近於理想的溫標就是根據熱力學第二定律定義的熱力學溫標(thermodynamic temperature scale),免去了過去各種經驗溫標的缺點,即不依賴某種特定的測溫物質。熱力學溫標出現後,使溫度量測真正具有科學意義;由熱力學溫標所定義的溫度稱為熱力學溫度。
理論上,只要物質的某項物理特性和溫度存有一個已知的關係式,即可用來量測熱力學溫度。通常可採用氣體溫度計,聲波溫度計、雜訊溫度計和輻射溫度計量測熱力學溫度,其中以氣體溫度計標定溫度所構成的氣體溫標最接近熱力學溫標。不過,由於氣體溫度計的複現性較差,實際上若依定義量測熱力學溫度是十分困難的,量測的準確度也很低。加上國際間協議定出國際實用溫標,統一國際間的溫度量值幾經變革,為此定出的溫度盡可能接近熱力學溫度。
早在1887年,國際度量衡局(International Bureau of Weights and Measures;BIPM) 的研究員Chappuis即採用定容氣體溫度計(氫氣、氮氣和二氧化碳)校正附在公尺原器(prototype metre)上的玻璃水銀溫度計,而後國際度量衡委員會(International Committee for Weights and Measures;CIPM)決定採用定容氫氣體溫度計或稱為常態氫溫標(the normal hydrogen scale)作為國際實用溫標的基礎;此決定在1889年獲得第1屆國際度量衡大會(General Conference on Weights and Measures;CGPM) 的追認。
1913年德國聯邦物理技術研究院(Physikalish Technische Reichanstalt, PTR,過後成為Physikalisch-Technische Bundesanstalt;PTB) 向BIPM建議以1899年英國物理學家卡倫得(Hugh Longbourne Callendar)所提的熱力學溫標作為國際實用溫標,此建議得到當時的美國國家標準局(National Bureau of Standards; NBS即美國國家標準與技術研究院NIST的前身) 以及英國國家物理實驗室(National Physical Laboratory;NPL) 的同意。
1923年美英德三國的國家實驗室共同採用一白金電阻溫度計決定溫標,其範圍涵水銀的凝固點(–38 °C) 至硫的沸點(444.5 °C) ,其定點溫標間的溫度係使用一個內插公式計算出;而後又提升至650 °C。在650 °C 至1100 °C之間的溫標則以一支鉑銠/鉑熱電偶確定鋅、銻、銀和金的凝固點。高於金的凝固點(1063 °C) 的溫度則建議使用光學的高溫計。這項非正式協議隨後有BIPM 和萊頓大學(University of Leiden)也參加更廣泛的討論。
在1925年,溫度計量學家們醞釀在1927年CIPM會議提出的一個擬定溫標草案,在這草案裡白金電阻溫度計的範圍延伸至 -193 °C。1927年第7屆國際計量大會決定採用1927年國際溫標(International Temperature Scale of 1927;ITS-27),規定了6個固定點,並以鉑電阻溫度計、鉑銠/鉑熱電偶,並規定在-182.97 ℃ (氧沸點)到1063 ℃ (金凝固點)之間確定一系列可重複的溫度固定點,金凝固點以上則以光學高溫計為外插實現溫標的儀具。此一國際溫標可以克服直接用氣體測溫法來實現熱力學溫標所發生的困難,並統一各國的溫標。此外,這一相當實用的溫標能容易且準確地重複產生,所提供的溫度值儘可能地接近當時所知的熱力學溫度。
1948年,國際度量衡大會對ITS-27作了若干重要修訂,例如: 0 °C以下的氧沸點(-182.97 °C) 之外插延伸的-190 °C被發現為不可靠,因IPTS-27 中只向下延伸至182.97 °C; 電阻溫度計和熱電偶之間的交叉點,從660 °C變為銻的凝固點630.5 °C;銀的凝固點溫度值由960.5 ℃改為960.8 ℃,因而改變了標準熱電偶溫度在630 ℃至1063 ℃範圍的量測值;輻射常數C2值以0.01438 mK代替原來的0.01432 mK,使高於金凝固點的溫度都改變了,並以普朗克黑體輻射定律(Planck's law, Blackbody radiation law)代替維恩定律 (Wien's law) 引用更精確的常數值,計算公式更為精確,進一步影響了高溫數值,高於金凝固點的溫度值被降低。第9屆CGPM確定了IPTS-48 (International Practical Temperature Scale of 1948 ),而且為了確保專有名詞的國際一致性,決定不再用“degree Centigrade"一詞而改用“degree Celsius"。
1958年CIPM 採用熱學諮詢委員會(Consultative Committee on Thermometry;CCT) 所提出的氦(4He)蒸氣壓對溫度的數據表,其涵蓋的範圍從0.5 K到5.23 K,即1958 4He溫標,在溫度量測上以T58表示。同年,CGPM增加一條重要修訂,即把水的三相點作為唯一的定義點,規定其絕對溫度值為273.16,以代替原來水凝固點為0.00攝氏度之規定。而水的為凝固點依據實測,應為273.1500 K ± 0.0001 K。採用水的三相點作為唯一的定義點是溫度計量的一大進步,避免世界各地因水凝固點變動而出現溫度計量的差異。
從1958年到1967年之間,包括位於莫斯科市的國家物理與無線電技術量測科學研究院(Physicotechnical and Radiotechnical Measurements Institute;PRMI) 、英國的NPL、美國NBS和賓州大學(Pennsylvania State University;PSU) 對於溫標的研究都有相當多貢獻。及至1967至1968年CGPM對國際實用溫標又作了一次修訂,稱為IPTS-68(International Practical Temperature Scale of 1968 )。其特點是採用當時有關熱力學的最新研究成果,使國際實用溫標更接近熱力學溫標。此次修訂規定以符號K表示絕對溫度,取消原來的符號(°K),並規定攝氏溫度與熱力學溫標的絕對溫度單位相等,並且等於水的三相點的熱力學的溫度之1/273.16。IPTS-68同時使用國際實用克耳文溫度(符號T68)及國際實用攝氏溫度(符號t68)。T68和t68之間的關係同於絕對溫度T和攝氏溫度t的關係:t68 = T68-273.15 K。
IPTS-68的基礎是對一些重複性平衡狀態(即定義定點)的溫度給予指定數值,以及這些溫度所校正的標準儀器。定點之間的溫度以內插公式使標準儀器的顯示值和國際實用溫度之數值互有關聯。由12.81 K至630.74 °C所使用的標準儀器是白金電阻溫度計,此溫度計的電阻元件必須有無應力、退火及高純度等特性。用於630.74 °C至1064.43 °C的標準儀器為鉑銠/鉑熱電偶,其熱電動勢與溫虔的關係是以一個二次方程式來表示。高於1064.43 °C時,係依普朗克黑體輻射定律,並以1064.43 °C (1337.58 K) 做為參考溫度。
1976年CIPM對IPTS-68作了一些修訂和補充,承認一份稱為1976的0.5 K到30 K暫行溫標(1976 Provisional 0.5 K to 30 K Temperature Scale;EPT-76) 的新低溫溫標,把溫度範圍的下限由13.8 K擴大到0.5 K,以消除IPTS-68在它下限尾端所發現的熱力學不規則性,並提供和5.2 K以下氦蒸氣氣壓溫標相連結的方法。EPT-76是在IPTS-68未完全修訂之前,所推薦使用的暫時性基準。不過,即使如此仍出現不足之處,主要是在實驗中不斷發現IPTS-68在某些溫度範圍與國際單位制定義的熱力學溫度偏差甚大。
1990國際溫標
國際溫標大約每20年作一次大幅的修訂,在IPTS-68實行以後之二十年間,在溫度量測領域上有很大的進展,IPTS-68和熱力學溫標之間的差異作了許多研究,實用量測技術和儀器方面有相當大的進步,促使CIPM開始著手修訂IPTS-68。
1989年國際度量衡委員會遵循1987年第18屆國際計量大會第7項決議的要求,在會議上決定自1990年1月1日起開始在全世界範圍內採用重新修訂的國際溫標,取名為1990年國際溫標(International Temperature Scale of 1968 ),簡稱為ITS-90,取消了「實用」二字,隨著科學技術水準的提高,此一溫標已經相當接近於熱力學溫標。該溫標取代了1968年的國際實用溫標(1975年修訂版)和1976年的0.5 K到30 K暫行溫標。和IPTS-68相比較,ITS-90實行後,在一大氣壓標準狀態下水的沸點不再是100 ℃,而是偏低0.026 ℃,即為99.974 ℃。
ITS-90不同於IPTS-68的重要特點如下︰以水的三相點 (273.16 K)為一個定點, 而不是水的凝固點 (273.15 K);延伸低溫至0.65 K而不再是 13.8 K;更接近於熱力學溫度;在連續性和精密方面有更進一步的改善;允許多種內插方法同時存在,因而在某些溫度範圍內可以很容易地將溫標實現;在某些範圍內有交替但實質上相等的定義;包含氦汽壓溫標;以一個插入氣體溫度計以作為實現溫標的儀具之一;作為界定儀器的白金電阻溫度計已從630 °C延伸到銀凝固點(962 °C) ;白金/鉑銠熱電偶不再是實現溫標的儀具;在962 °C以上的溫度係以普朗克輻射定律定義,以光學高溫計為實現溫標的儀具,從銀凝固點(962 °C)開始而不再金點(1064 ℃),但仍可選擇銀、金或銅任何一個凝固點當作此溫標的參考點。
ITS-90的訂定原則和過去溫標訂定時一樣,所指定的內插實現溫標的儀具有相當高的精確度和再現性,對於內插的操作程序也都有明確的規定。其主要的修訂內容可簡單歸納如下:
一、溫度單位
熱力學溫度(符號為T)是基本物理量,其單位為克耳文(符號為K),定義為水三相點的熱力學溫度的1/273.16。由於早期溫標定義方式係根據與273.15 K(水凝固點)的差值來表示溫度,因此仍保留這個慣例來表達一個溫度。以這種方法表示的熱力學溫度T被稱為攝氏溫度,符號為t,定義為t / ˚C=T / K — 273.15。攝氏溫度的單位為攝度,符號為˚C。根據定義,其大小(magnitude)與克耳文相同,即1攝度溫差等於1克耳文溫差 (1 ℃ = 1 K)。溫差可以用克耳文或攝氏度來表示。
ITS-90定義了國際克耳文溫度(符號T90,)和國際攝氏溫度(符號t90)。T90和t90之間的關係與T和t之間的關係相同,即t90 / ˚C = T90 / K — 273.15。物理量T90的單位為克耳文(K),物理量t90的單位為攝度(˚C),與熱力學溫度T 和攝氏溫度t的情況一樣。
二、1990年國際溫標(ITS-90)的原理
ITS-90從0.65 K往上延伸到依據普朗克輻射定律使用單色輻射可實際量測的最高溫度。ITS-90包含許多溫度範圍和次溫度範圍(sub-range),在每個溫度範圍和子溫度範圍上定義了溫度T90。有幾個溫度範圍或次溫度範圍是重疊的,在發生這樣的重疊時,有T90的不同定義存在,但這些不同的定義具有同等狀態。對於精密度極高的量測,在同一溫度下按照不同定義進行的量測之間可能會檢測到數值的差異。同樣,即使採用同一個定義,用兩個合格的內插式儀器(如電阻溫度計)在定義溫度定點之間量測同一溫度時,也可能得出T90的明顯數值差異。不過,幾乎在所有情況下,這些差異在實際操作中都小到可忽略不計。
ITS-90在整個範圍內,T90的量測與直接量測熱力學溫度相比要方便得多,且更為精密並有很高的複現性。
三、1990年國際溫標的定義
- 第一溫度範圍為0.65 K至5.0 K之間,T90是以3He和4He的蒸氣壓與溫度的關係來定義,再利用指定的公式計算溫度。
- 第二溫度範圍為3.0 K至氖三相點(24.5561 K)之間,T90是用氦氣體定容溫度計定義的,該溫度計使用分配有數值(定義定點)的三個能以實驗實現的溫度,再用規定的內插方法來校正。
- 第三溫度範圍為平衡氫三相點(13.8033 K)到銀凝固點(1234.93 K)之間,T90是由白金電阻溫度計定義的,該溫度計使用一組指定的定義固定點,再利用規定的內插方法來校正。
- 銀凝固點(1234.93 K)以上的溫度範圍,T90是按一個定義固定點和普朗克輻射定律來定義的,實現的儀器為光學高溫計。
1990年國際溫標ITS-90的定義定點如表一。在2000年10月,CIPM批准一個臨時的低溫溫標 (Provisional Low Temperature Scale of 2000;PLTS-2000),它將ITS-90的低溫延伸至0.9 mK。它是基於固態氦(3He) 的熔化壓(melting pressure),因為敏感性和可靠性之故,可以量測較寬的範圍。
由於1990年BIPM所規定水三相點的水之定義不夠嚴謹,使得水三相點在國際比對上有很大的差異。經過CCT幾年的分析研究後,2005年CIPM聲稱為了闡明水三相點的溫度,克耳文所定義的水應具特定的同位素成分,其同位素結構同於國際原子能機構(International Atomic Energy Agency;IAEA) 發佈的參考物質-維也納標準海水(Vienna Standard Mean Ocean Water;VSMOW) ;即每莫耳1H含0.000 155 76莫耳2H、每莫耳16O含0.000 379 9莫耳17O以及每莫耳16O含0.002 005 2莫耳18O。
表一 ITS-90的定義定點
| 編號 | 溫度 | 物質a | 狀態b | Wr(T90) | |
|---|---|---|---|---|---|
| T90/K | t90/˚C | ||||
| 1 | 3 to 5 | -270.15 -268.15 |
He | V | |
| 2 | 13.8033 | -259.3467 | e-H2 | T | 0.0001 190 07 |
| 3 | ≒ 17 | ≒ -256.15 | e-H2 (or He) |
V (or G) |
|
| 4 | ≒ 20.3 | ≒ -252.85 | e-H2 (or He) |
V (or G) |
|
| 5 | 24.5561 | -248.5939 | Ne | T | 0.008 449 74 |
| 6 | 54.3584 | -218.7916 | O2 | T | 0.091 718 04 |
| 7 | 83.8058 | -189.3442 | Ar | T | 0.215 859 75 |
| 8 | 234.3156 | -38.8344 | Hg | T | 0.844 142 11 |
| 9 | 273.16 | 0.01 | H2O | T | 1.000 000 00 |
| 10 | 302.9146 | 29.7646 | Ga | M | 1.118 138 89 |
| 11 | 429.7485 | 156.5985 | In | F | 1.609 801 85 |
| 12 | 505.078 | 231.928 | Sn | F | 1.892 797 68 |
| 13 | 692.677 | 419.527 | Zn | F | 2.568 917 30 |
| 14 | 933.473 | 660.323 | Al | F | 3.376 008 60 |
| 15 | 1234.93 | 961.78 | Ag | F | 4.286 420 53 |
| 16 | 1337.33 | 1064.18 | Au | F | |
| 17 | 1357.77 | 1084.62 | Cu | F | |
註a :除3He外,所有物質都是天然同位素組成。e-H2是正、仲分子形式處在平衡濃度下的氫。
註b :關於這些不同狀態的完整定義和實現這些狀態的建議,請參見 “ITS-90補充資料”。符號含義如下︰V指蒸氣壓點;T指三相點(固相、液相和氣相平衡的溫度);G指氣體溫度計點;M、F分別指熔點、凝固點(在101 325 Pa的壓力下,固相和液相平衡的溫度)。
國際溫標的發展
自從CIPMI決定1990年起採用ITS90之後,距今超過20年了,在這20多年當中世界各計量科學較先進的國家仍持續地對溫標進行研究,欲將溫標的範圍往銅凝固點(1084.62 ℃)以上的高溫範圍及-270.15 ℃(3 K)以下的極低溫範圍延伸。
在極低溫範圍方面,研究成果PLTS-2000的採用,已使溫標延伸至0.9 mK至1 K的範圍。這對於極低溫研發、太空發展等尖端領域的工作,以及液態氣體、超導、醫藥、食品等產業所不可或缺的極低溫量測之標準追溯和提升可靠度,有非常大的影響。
而在1084.62 ℃以上極高溫範圍方面,由於航太工業、能源及高溫原料產業上,對所使用的高溫材料的製造和精密評估,必需用到在量測極高溫仍需正確的溫度計,如為節能省碳使飛機和汽車輕巧化而使用的碳纖維強化聚合物(carbon fiber–reinforced polymer) ,其基本素材碳纖維在石墨化處理(graphitization treatment)時,就必需在2500 ℃以上的極高溫下進行。在品質管理上,溫度量測結果的正確追溯及高溫溫度計的校正均非有極高溫的定點不可。
目前已有些國家實驗室已利用金屬-碳合金的共晶點或稱共熔點(eutectic point)建立了輻射高溫定點,如:鐵碳合金(Fe-C;1153 ℃)、鈷碳合金(Co-C;1324 ℃)、鈀碳合金(Pd-C;1492 ℃) 、鉑碳合金 (Pt-C;1738 ℃)、錸碳合金(Re-C;2474 ℃),以及利用碳化金屬與碳的包晶點或稱轉熔點(peritectic point) 所建立的2500 ℃以上的極高溫定點拯:碳化鎢/碳合金WC-C (2748 ℃)。按以往的國際溫標的變遷史,過去大約每20年會有一次大幅的修訂,可以說現今距下次修訂的時機大概也不遠了。
我國的溫度國家標準
溫度量測與民生、醫療、衛生、工業、環保、航太以及國防等各方面都有密切的關連,不過要得到正確的溫度量測結果,則有賴於量測技術的精進、量測儀器精密度的提昇、量測標準的追溯等諸多因素的配合。
我國國家度量衡標準實驗室(National Metrology Laboratory;NML) 自成立以來,即對溫度標準的建立不遺餘力,其研究涵蓋各種接觸或非接觸式的溫度量測標準、國際溫標ITS-90各項溫度定點的建立。目前已建置並可提供各式溫度計之校正服務的量測系統有:輻射溫度計校正系統:校正範圍為 800 ℃至1500 ℃和10 ℃至90 ℃;熱電偶溫度計量測系統:校正範圍為0 ℃至1100 ℃和1100 ℃至1200 ℃;電阻溫度計量測系統:校正範圍為 -70 ℃至300 ℃;白金電阻溫度計定點量測系統:校正範圍為 -190 ℃至962 ℃;光學高溫計量量測系統:校正範圍為800 ℃至1700 ℃。
對於ITS-90所定的溫度定點的建立方面,位於工業技術研究院技術研究院量測技術發展中心的國家標準實驗室已建置氬(Ar)三相點(-189.3442 ℃)、汞(Hg)三相點(-38.8344 ℃)、水(H2O)三相點(0.01 ℃)、鎵(Ga) 熔點(29.7646 ℃)、銦(In)凝固點(156.5975 ℃)、錫(Sn)凝固點(231.928 ℃)、鋅(Zn)凝固點(419.527 ℃)、鋁(Al)凝固點(660.323 ℃)、銀(Ag)凝固點(961.78 ℃)。此外, NML於2010年底建置開放式溫度定點量測系統,該系統之溫度定點囊可以藉由氣體系統,於實現溫度定點過程中控制並量測氣體壓力,以符合國際溫標(ITS-90)之要求。
溫度標準未來發展
近10年來,科學家們擬重新以物理量基本常數定義國際單位制(SI units)基本單位,除了針對目前唯一仍以人工實物(material artifact)進行定義的基本單位-公斤重新對定義之外,對於其他包括克耳文在內的基本單位也擬以基本物理常量定義之。
2005年, CIPM即建議對於作為熱力學溫度單位的克耳文重新有一個更嚴格的定義。其中建議克耳文雖仍保留使用,但其大小則以波茲曼常數(Boltzmann constant ) 之正確值1.3806505×10−23 J/K來定義。原文為“The kelvin, unit of thermodynamic temperature, is such that the value of the Boltzmann constant is k = 1.380 6505 joules per kelvin exactly.”。
因為波玆曼常數是溫度和能量關係的物理常數,單位J/K,其量綱(或稱因次)為m2 kg s-2 K-1,如此熱力學溫度即可從長度、時間、質量來定義。再者,波玆曼常數又是氣體常數(gas constant)和亞佛加厥常數(Avogadro constant)的比,克耳文亦可從質量新定義也能和亞佛加厥常數或普朗克常數(Planck's constant)建立關係。
從科學的觀點來看,這個新定義會使克耳文和其它基本單位連接起來,可以不再依賴於某種特定物質在某特定溫度下的特性決定。從實際的觀點來看,這個新定義不會造成任何大的影響,水在一個大氣壓下的凝固點仍然是 273.15 K (0 °C)。CIPM提出應重新定義克耳文時,希望這個項目會在2011年的CGPM上通過。但是到了2011年,這個提議又被延後到2014年。
